Bătălia împotrivă cancerului este tot mai dificilă, iar numărul pacienților diagnosticați cu această maladie este în continuă creștere. Însă o veste bună a venit pentru pacienții de cancer în aceste zile.
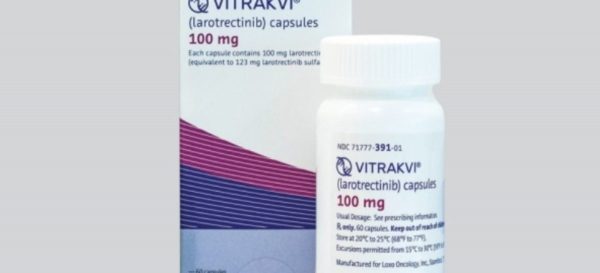
Comisia pentru Medicamente de Uz Uman (CHMP) din cadrul Agenției Europene a Medicamentului (EMA) a emis o recomandare pentru aprobarea de punere pe piață a medicamentului Vitrakvi (larotrectinib). Decizia finală din partea Comisiei Europene este așteptată în următoarele luni.
Medicamentul este deja aprobat în Statele Unite ale Americii, precum și în Brazilia și Canada. Acesta este indicat pentru tratamentul copiilor și adulților cu tumori solide care prezintă o fuziune a genei NTRK (receptor de tirozin-kinază neurotrofică), local avansate sau metastatice.
Vitrakvi, produs de grupul Bayer, este primul tratament „histologic independent”, recomandat pentru aprobare în Uniunea Europeană. Aceasta înseamnă că poate fi folosit pentru a trata tumorile nehematologice (adică care nu încep în sânge sau măduva osoasă) cu această mutație specifică, indiferent de zona în care și-a avut originea tumora. Înainte ca pacienții să poată primi tratamentul, prezența mutației în tumoră trebuie confirmată printr-un test genetic valid.
Substanța activă din Vitrakvi – larotrectinib – țintește o modificare genomică foarte specifică a tumorii unui pacient. Acest lucru se produce atunci când genele NTRK, care codifică proteine specific, fuzionează intr-un mod haotic cu alte gene. Această mutație, numită fuziunea genelor NTRK, duce la dezvoltarea proteinelor care pot determina creșterea tumorală. Vitrakvi blochează acțiunea acestor proteine și, în acest sens, inhibă dezvoltarea cancerului.
Genele NTRK sunt rare, dar apar în multe tipuri de cancer, care afectează atât adulții, cât și copiii.
Fuziunea NTRK, de exemplu, este la originea cancerului doar în 0,5-1% din numărul total de cazuri de tumori solide.
„Pe măsură ce învațăm tot mai multe despre genomica tumorii, devine cu atât mai important să asigurăm accesul la testări pe scară largă, pentru a permite identificarea și tratarea pacienților care au potențialul de a beneficia de medicina de precizie ”, a declarat Scott Fields, Directorul Departamentului de Oncologie de la Bayer.
Eficacitatea și siguranța medicamentului Vitrakvi au fost evaluate în cadrul a trei studii cu un singur braț de tratament (adică studii fără grup de control), care au inclus un număr de 102 adulți și copii cu cancer. Este vorba despre pacienții care au primit deja terapie standard sau pentru care intervenția chirurgicală nu reprezintă o soluție sau nu răspund la terapiile disponibile.
Ponderea pacienților care au răspuns la tratamentul cu Vitrakvi a fost de 67%. În cazul a 88% dintre aceștia răspunsul a durat cel puțin 6 luni, iar în cazul a 75% a durat până la 1 an. S-au
observat răspunsuri tumorale atât în cazul tumorilor rare, cum ar fi fibrosarcomul infantil și tumorile glandelor salivare, cât și în afecțiuni frecvente, precum cancerul pulmonar și de colon.
Cele mai frecvente reacții adverse au fost oboseala, creșterea nivelului de enzime hepatice, amețeli, constipație, greață, anemie (număr scăzut de globule roșii) și vărsături.
CHMP a recomandat o aprobare condiționată pentru acest medicament.
Vitrakvi va fi disponibil sub formă de soluție orală (20 mg / ml) și capsule (25 și 100 mg).