Consiliul Național al Dizabilității din România (CNDR) se alătură Asociației Rebeca Faith Hope Love, ambele organizații trag un semnal de alarmă și solicită Ministerului Finanțelor Publice să urgenteze semnarea proiectului pentru modificarea HG 720/2008 privind introducerea pe lista de medicamente compensate a produsului Cerliponasum alfa (brineura), medicament orfan, singurul disponibil pe plan mondial pentru boala Batten, afecțiune neurodegenerativă.
Incidența în această boală este de 1/100000. În România sunt 14 copii bolnavi, toți plecați în alte țări, nouă dintre ei primesc tratament în țări din Europa (Germania, Italia, Austria și Anglia). În România vor continua tratamentul trei pacienți. Cel din Germania termină studiul clinic la sfârșitul lunii martie 2020, ceilalți doi din Italia îl primesc prin donație de la firma producătoare și nu se știe până când.
Fără tratament, acești micuți nu mai pot merge, riscă să își piardă vederea și vorbirea. Fără tratament sunt condamnați la moarte!
ANMDM a emis decizie condiționată de punere a produsului Cerliponasum alfa (brineura) pe lista medicamentelor compensate în luna martie 2019, în luna decembrie 2019, CNAS a semnat un contract cost volum cu producătorul. CNAS a alocat banii pentru acest tratament pentru cinci pacienți, pentru anul 2020! CNAS a avizat pozitiv acest proiect!
Brineura este un tratament fără alternativă terapeutică pentru boala Batten
Pentru copiii cu Batten nu mai este timp fizic, nu există data viitoare! Fiecare minut contează!
Micuții care suferă de boala Batten nu au dreptul la tratament în țara lor, pentru că birocrația din România îngreunează acest proces care durează de doi ani de zile.
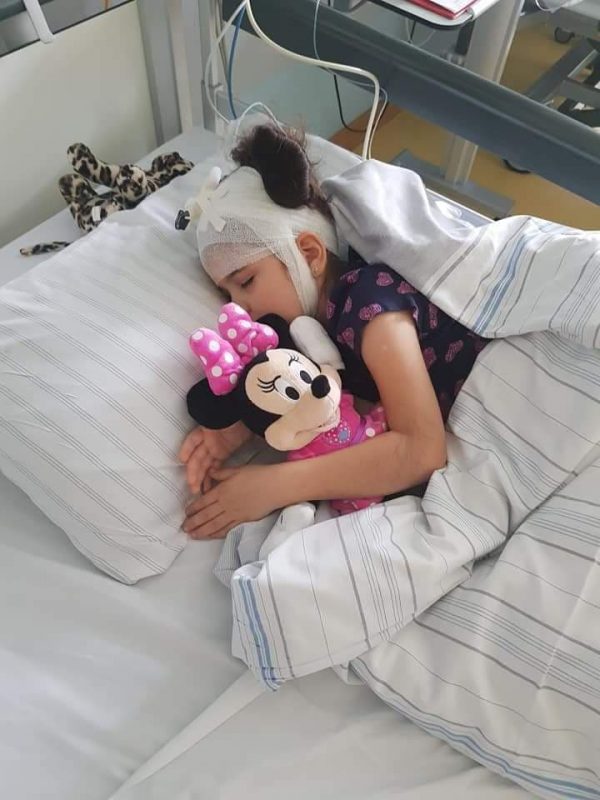
”Rebeca, fetița mea, are șase ani și în fiecare secundă din viața ei luptă cu boala, o anomalie genetică pentru care nu există leac, ci doar speranță. România îi refuză dreptul la tratament și o condamnă să își piardă vederea, simțul vorbirii, să nu mai poată mânca și merge. Rebeca face tratament în Germania; ne-am mutat la Hamburg pentru a o salva. Avem nevoie de un astfel de tratament în România, pentru că acum facem drumuri între Germania și România. Acolo i se fac infuziile în creier, aici facem terapiile. Copiii cu boli rare și copiii cu probleme neurologice există și ei în România. Nu trebuie ignorați sau izolați, au dreptul la viață!”, a declarat Adnana Cotolea, vicepreședinte Asociația Rebeca Faith Hope Love, mama Rebecăi, fetița diagnosticată cu boala Batten.
Copiii români diagnosticați cu acestă boală au șanse de supraviețuire doar în statele în care tratamentul este decontat, în condiții stricte. Familiile au fost nevoite să fugă pur și simplu în străinătate pentru că statul român nu le oferă nicio șansă.
Acest lucru se întamplă și cu cel mai recent caz diagnosticat în România. O fetiță de șase ani, care este nevoită să înceapă tratamentul la Roma.
”Șansele de recuperare ale copiilor diagnosticați cu Batten cresc, daca terapiile se desfășoară în limba maternă. Mai mult decât atât, este important ca acești copii să se întoarcă în țară, dacă privim din perspectiva familiei, resursa cea mai importantă pentru acești copii. Nu sunt toate situațiile la fel că spunem: ”dacă au tratament acolo, este o soluție să stea acolo”. Dincolo de faptul că nu este o intervenție pe termen scurt și că este un drept de a avea tratament în țară, suportul psihoemoțional pe care părinții copiilor îl pot primi în țară de la persoane semnificative este cu mult mai mare. Aprobarea unei reglementări pentru a face tratamentul în țară este un drept, dar și o șansă în plus pentru Rebeca și copiii cu boli rare”, a declarat Nicoleta Larisa Albert, psiholog.
Despre Asociația Rebeca Faith-Hope-Love și demersurile sale
În România, pentru viața copiilor diagnosticați cu lipofuscinoza ceroid neuronală tip 2 (boala Batten) luptă Asociația Rebeca Faith-Hope-Love, care funcţionează în baza prevederilor O.G. nr.26/2000, respectiv Legea nr. 246/2005, ca persoană juridică română, de drept privat, fără scop lucrativ sau patrimonial, independentă și neguvernamentală. Asociația are ca scop apărarea intereselor și drepturilor fundamentale ale copiilor cu nevoi speciale și pe membrii familiilor acestora, luptând în același timp pentru dezvoltarea serviciilor medicale necesare în diagnosticarea și tratarea acestor pacienți.
Copiii cu boala Batten sunt născuți fără varianta funcțională a CLN2, gena responsabilă de sinteza proteinelor lizozomale ce distrug lipofuscina. Astfel lipofuscina se acumulează și produce leziuni neuronale ireversibile. Nou născuții cu aceasta afecțiune par normali atunci când vin pe lume, însă începând cu vârsta de doi, până la patru, ani încep să aibă manifestări ale unei slabe dezvoltări a sistemului nervos, însotițe frecvent de crize de epilepsie. Orbind și ajungând să fie complet paralizați, copiii mor în jurul vârstei de 8-12 ani.
Reglementări
Ordinul Ministerului Sănătății Publice și al Președintelui Casei Naționale de Asigurări de Sănătate nr. 574/269/2008, cu privire la normele tehnice de realizare a Programelor Naționale de Sănătate, face referire la bolile rare.
,,Art.I – pct.6, pct.b) asigurarea medicamentelor specifice necesare tratamentului în ambulatoriu al bolnavilor cu unele afecțiuni rare”
Începând cu data de 01.06.2017, European Medicines Agency (EMA), a aprobat Brineura.
Brineura conţine substanţa activă cerliponază alfa, care aparţine unei grupe de medicamente cunoscute sub denumirea de terapii de substituţie enzimatică. Este utilizat pentru tratamentul pacienţilor cu lipofuscinoză ceroidă neuronală de tip 2 (CLN2), afecţiune denumită şi deficit de tripeptidil peptidază-1 (TPP1). Persoanele afectate de boala CLN2 nu au o enzimă numită TPP1 sau au un nivel foarte scăzut al acestei enzime, ceea ce determină o acumulare de substanţe numite materiale de stocare lizozomală. La persoanele cu boala CLN2, aceste materiale se acumulează în anumite părți ale corpului, în principal în creier.
Cum acţionează Brineura?
Acest medicament înlocuieşte enzima lipsă, TPP1, ceea ce micşorează acumularea materialelor de stocare lizozomală. Acest medicament acţionează prin încetinirea evoluţiei bolii și chiar stopare dacă tratamentul se începe în faze incipiente ale bolii.
Cum se administrează Brineura?
Copilului care suferă de CLN2 i se va efectua o procedură chirurgicală pentru implantarea dispozitivului pentru administrarea de Brineura. Dispozitivul ajută medicamentul să ajungă într-o anumită parte a creierului. Brineura va fi administrat de un medic cu experienţă în administrarea medicamentelor pe cale intracerebroventriculară (prin perfuzie în lichidul din jurul creierului) în cadrul unui spital sau unei clinici.
Luând în considerare toate aceste beneficii și faptul că de acest tratament deja beneficiază copii cu CLN2 din alte state ale Uniunii Europene, precum și dreptul la viață și de acces la tratamente medicale aprobate:
• În septembrie 2018 ANMDM a aprobat cererea prețurilor de producator, cu ridicata și cu amănuntul maximale, pentru produsul Brineura 150 mg soluție pefuzabila 150 mg prin adresa nr. 42350/28.08.2018.
• În decembrie 2018 A&D Pharma Marketing & Sales Services, în calitate de reprezentant în România al companiei Biomarin, a depus spre evaluare dosarul în vederea susținerii de includere a medicamentului orfan, Brineura 150 mg soluție pefuzabilă 150 mg în Lista cuprinzând denumirile comune internaționale corespunzătoare medicamentelor care se acordă în cadrul programelor naționale de sănătate (nr. înregistrare 30478/12.12.2018).
• În martie 2019 s-a emis RAPORT DE EVALUARE A TEHNOLOGIILOR MEDICALE DCI: Cerliponasum alfa INDICAȚIA: LIPOFUSCINOZA CEROIDĂ TIP2 (DEFICIT DE TRIPEPTIDIL PEPTIDAZA-TPP1).
Cu concluzia: Conform Ord.M.S. 387/2015 care modifică și completează Ord.M.S. 861/2014 privind aprobarea criteriilor și metodologiei de evaluare a tehnologiilor medicale, medicamentul cu DCI Cerliponasum alfa întrunește punctajul (65) de admitere condiționată în Lista care cuprinde denumirile comune internaționale.
• Pe 16 mai 2019 A&D Pharma a depus cererea pentru negocieri în cadrul unui contract cost volum nr. 4030/16.05.2019.
• Pe 13 iunie 2019 CNAS a cerut numărul de pacienți eligibili pentru tratamentul cu Brineură.
• Pe 2 iulie 2019 a fost publicat numărul de pacienți eligibili pentru tratamentul cu Brineură.
• În termen de maxim 5 zile A&D Pharma a depus documentația cerută.
• În luna decembrie 2019 CNAS a semnat contractul cost volum cu deținătorul de APP.
Semnatari ai demersului:
Daniela TONTSCH- președinte CNDR
Adnana Cotolea – Vicepreședinte Asociația Rebeca Faith Hope Love
Pentru declarații și alte informații:
Adnana Cotolea – Vicepreședinte Asociația Rebeca Faith Hope Love
Telefon: 0723.637.664